臨床研究中核病院
患者申出療養
患者申出療養
2016年4月1日に患者申出療養制度が施行されました。患者申出療養制度は、国内未承認の医薬品等を保険外併用療法として使用したいという患者さんの思いに応えるために創設された患者さんの申出を起点とする新たな保険外併用療法の仕組みであり、将来的に保険適用につなげるためのデータ、科学的根拠を集積することを目的としています。東大病院は、厚生労働省の定める医療法に基づく臨床研究中核病院群の一つとして、本制度の実施に中心的役割を担います。
臨床研究推進センターは、患者申出療養を実施する際に、試験計画の立案等について支援します。
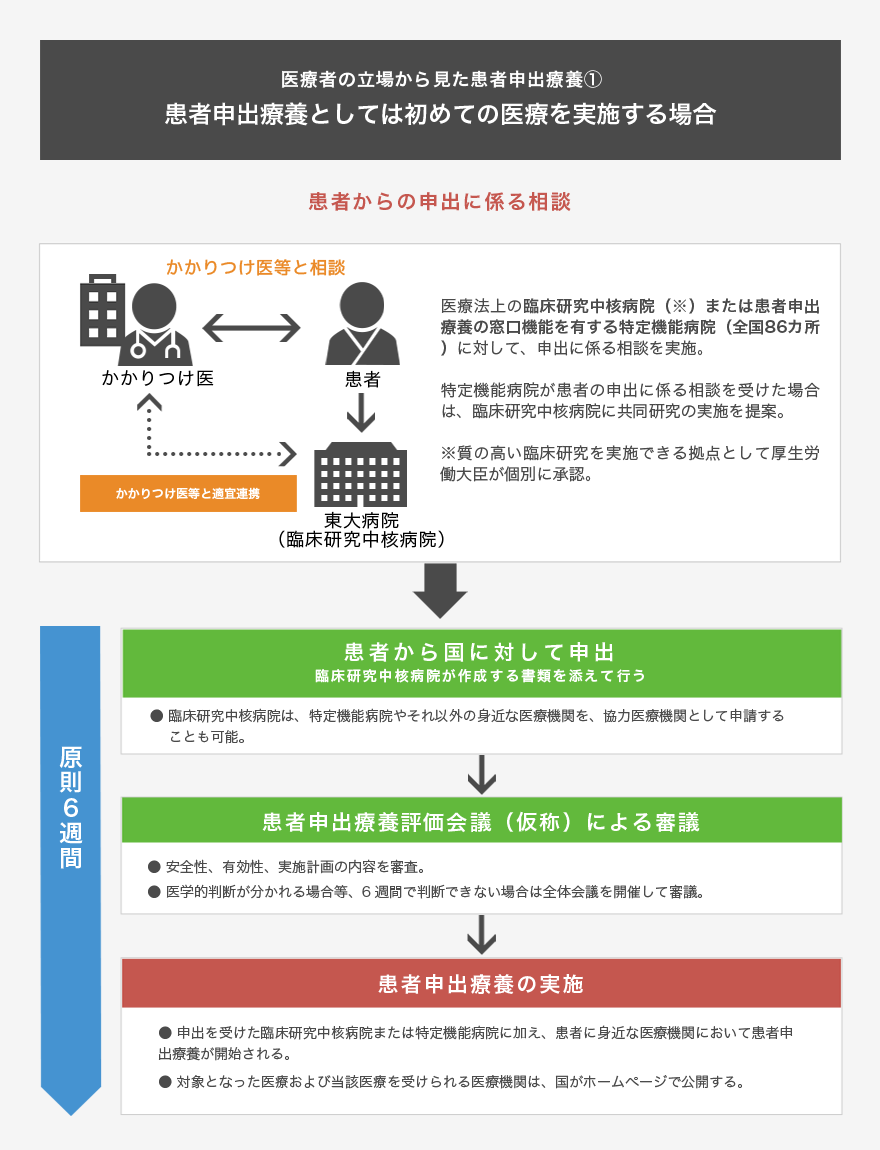
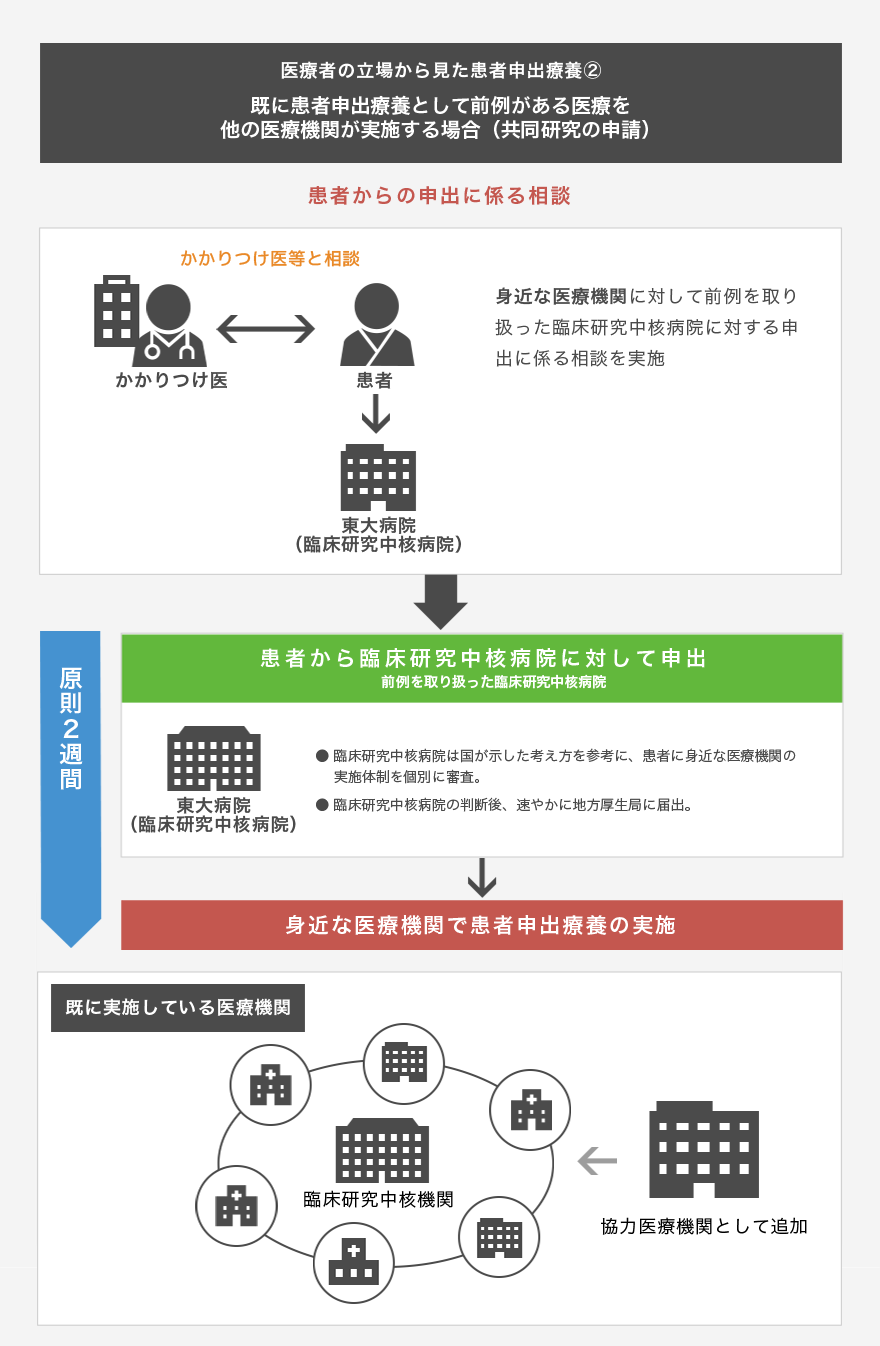

我が国における未承認薬や適応外薬の使用は、臨床研究の枠組みの中で使用する場合と、診療として使用する場合に大別されます。前者には、企業治験、拡大治験(日本版コンパショネートユース)、医師主導治験、先進医療B等が該当し、後者には、自由診療、個人輸入、海外で実施されているコンパショネートユースへの参加、症状詳記を要する診療等が含まれます。患者申出療養は、このうち前者に分類され、先進医療Bと同様に保険外併用療養費制度の一つとなっています。保険外併用療養費制度では、医療費の構成は、基礎的部分(入院基本料などの保険適用部分)と上乗せ部分(保険適用外部分)に分けられ、上乗せ部分は患者さんの全額自己負担となります。
患者申出療養の対象とする医療は、(1) 国内外の使用実績や有用性を示す文献などの科学的な根拠に基づき、一定の安全性・有効性等が確保できる治療法であること、(2) 国内で同様の試験計画の治験が実施されていないこと、(3) 基本的に保険収載を目指した臨床研究として実施すること、が主な条件となります。
臨床研究として実施するため、臨床研究法、倫理指針または再生医療等安全性確保法に準拠した研究実施計画書が必要であり、倫理審査委員会等の承認や、介入を伴う臨床研究に準じたインフォームド・コンセントを受ける必要があります。患者さんの自己負担金額が大きいこと、実施まで一定の時間が必要であることは依然として大きな課題ですが、適応のある患者さんにとっては魅力的な新制度と考えられます。
厚生労働省ホームページ: http://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000114800.html
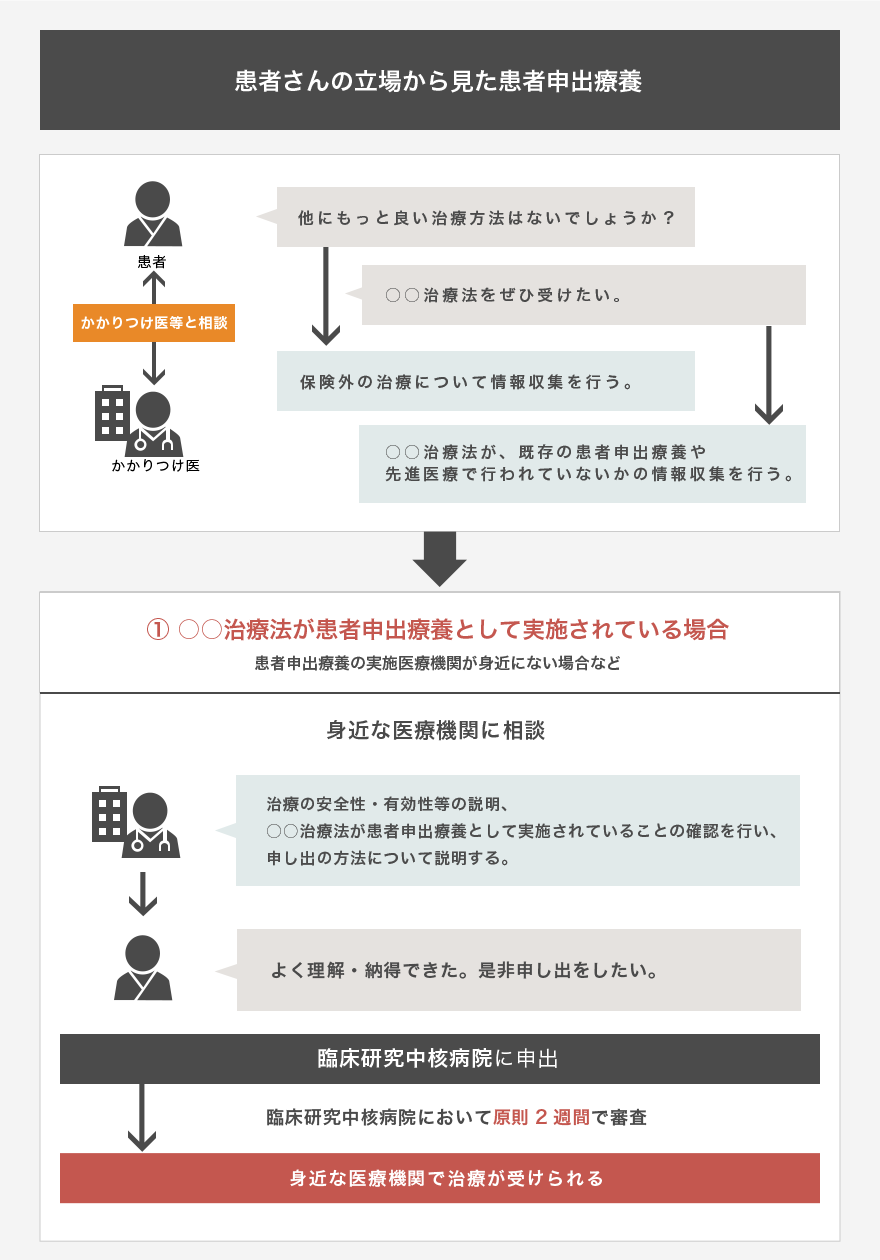
東大病院では、患者申出療養に対応するため、臨床研究推進センター臨床試験相談窓口に情報を集約し、患者申出療養に関する問い合わせに対して専門的かつ統一した回答を行うとともに、臨床研究コーディネーターや臨床心理士が、各種問い合わせや相談の中から、患者申出療養として妥当な案件を的確に抽出し、他の医療機関を含めて治験や先進医療B等で実施中の案件があれば、当該研究を実施している研究者に連絡を行います。また、各診療科の患者申出療養制度担当医師と、臨床試験相談窓口が連携し、診療科内での情報共有、主たる研究者を定めての研究計画立案に協力するとともに、必要に応じて他の診療科へ紹介を行います(上記の図 『患者さんの立場から見た患者申出療養①~③をご参照ください)。
患者申出療養の利用を希望された患者さんにとって最善の治療法を、国内・海外既報を精査し、有効性・安全性の検討をした上で、患者申出療養としての臨床研究を実施することを決定したら、研究計画の立案、必要書類(実施届出書、実施計画書、説明文書・同意文書等)の作成、医事課・研究推進課との連携、厚労省担当者との出口戦略まで含めた打合せ等を行います。臨床研究推進センターは、臨床研究ガバナンス部と協力し、薬事承認・保険収載へのロードマップ相談(厚労省担当者との出口戦略まで含めた打合せ等)、研究デザイン検討、書類作成支援、実施支援(プロジェクト管理、品質管理・品質保証等)、各部門見積の算出を行います。
患者申出療養についてのお問い合わせ
患者申出療養を含めた患者さんの治療・検査については、まずおかかりの診療科または主治医・担当医にご相談下さい。患者さん一人ひとりの状態などにより、ご希望される患者申出療養を受けられない場合もあります。
東大病院で実施している患者申出療養に関しての全般的なお問い合わせは、臨床研究推進センターまでご連絡下さい。
