企業主導治験(GCP)
モニタリング・監査およびGCP実施調査への対応
直接閲覧(SDV:Source Data Verification)とは?
■原資料(元となる文書、データ及び記録)を直接閲覧することによりモニタリングや監査を行う行為の一つを指します。
モニタリングとは? ― 品質管理(QC:Quality Control)の一部です
■治験の信頼性向上の為に必要です。
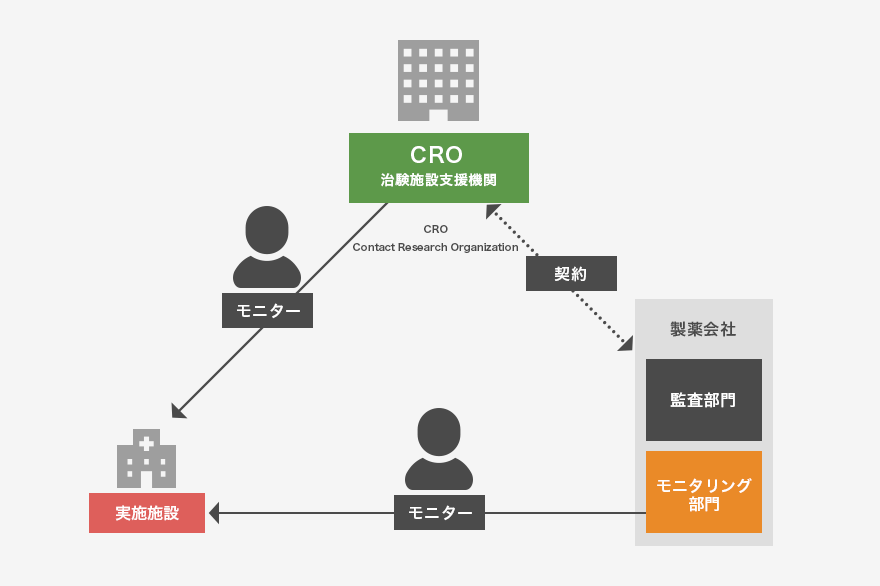
■治験が実施計画書通り行われているかを治験依頼者より指名されたモニターが確認する作業(直接閲覧等)であり、治験責任医師はこれを受け入れなければなりません。
モニタリングの目的
■治験実施医療機関および治験責任医師の選定のための、適格性の調査
■治験がGCPおよび治験実施計画書を遵守して実施されていることの確認
■症例報告書が医療機関の原資料に基づいて記録されていることの確認
■治験依頼者と治験責任医師、実施医療機関との間の情報交換
監査とは?―品質保証(QA:Quality Assurance)
■モニタリング部門と独立した監査部門が治験の品質保証(QA)の一環として、治験が治験実施計画書、GCP等を遵守して行われていたか否かを評価することです。
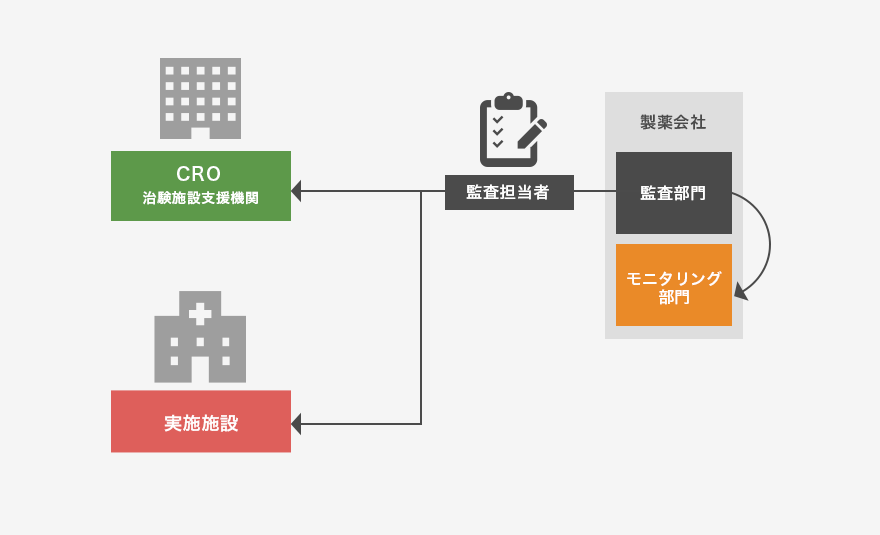
監査の種類とその目的
■治験のシステムに対する監査
治験依頼者、医療機関等における治験システムが適正に構築され、適切に機能しているかを評価することです。
■個々の治験に対する監査
治験が治験実施計画書、GCP等を遵守して行われているか否か、また治験で得られた成績の信頼性が確保されているか否かを評価することです。
GCP実施調査とは?
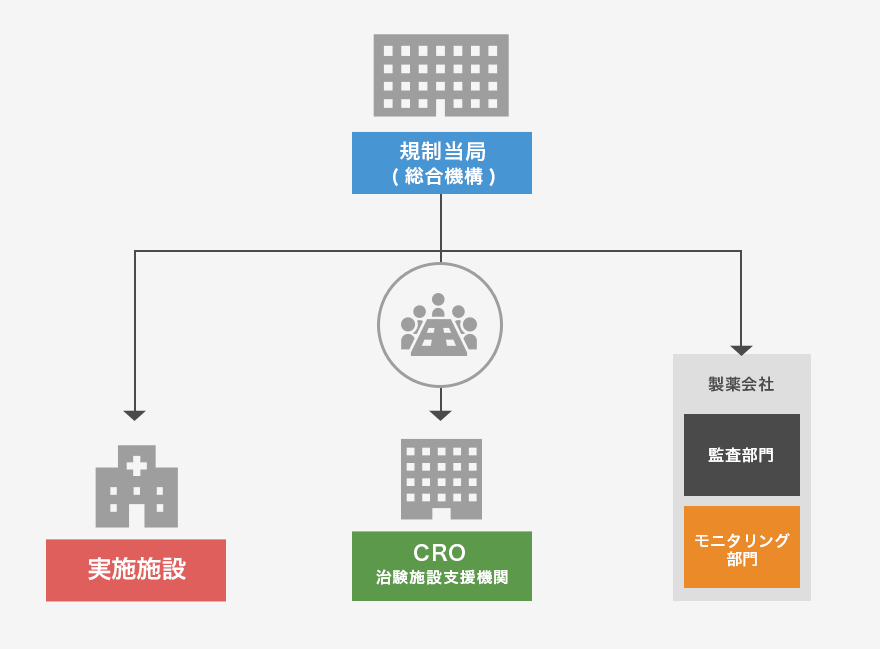
■新医薬品のGCP実地調査は、厚生労働省医薬食品局審査管理課長通知「GCP実地調査の実施要領について」(平成16年3月31日 薬食審発第0331012号)を踏まえて実施されます。
■厚生労働省から委託を受けた医薬品医療機器総合機構(PMDA)の担当職員が治験依頼者及び治験実施医療機関等に対して行う実地の調査のことです。
■選定された調査対象医療機関のみ実施されるため、全ての施設がGCP実地調査の対象となるわけではありません。
当院におけるモニタリング・監査の実際(医療関係者の方へ)
主にモニタリングでは、症例報告書と原資料(カルテ等)の整合性を確認します。当院ではモニタリング・監査の際は、治験責任医師または分担医師、及び臨床研究推進センターのスタッフが立ち会うことを原則としています。
治験責任医師・分担医師の主な業務
■モニター担当者より特に医学的判断を伴う部分の確認を求められた際はご対応頂きます。
■CRFへの記載の際に捺印が必要な場合があります。適宜署名捺印リストに登録した印鑑をご持参下さい。
治験責任医師の主な業務
■多くの試験では、CRF記載とモニタリングが終わると、適宜CRFが回収されます。 回収前には治験責任医師による内容のご確認と共に、署名や捺印が必要となることがあります。適宜署名捺印リストに登録した印鑑をご用意下さい。
実施日時の調整
■モニター・監査担当者と担当者間にて、試験スケジュール、治験担当医師の都合、モニタリング室の使用状況等を確認の上、日時を調整します。
■院外のモニター・監査担当者は個人情報eラーニングの受講が必須です。申込の詳細は企業治験の「モニタリング・監査」のページも参照ください。
■モニタリングの回数や実施のタイミングは試験毎に異なります。
■モニタリング対応時間は平日9時より16時です。
実施場所について
■原則的に臨床研究推進センターのモニタリング室(中央診療棟 6F)にて行っています。
準備
■治験の開始と同時に症例報告書(CRF:Case Report Form)を作成していただきます。
■医学的判断の伴わない箇所(検査データや併用薬等の転記)はCRCにて症例報告書へ転記することが可能です。
■直接閲覧に必要な原資料は臨床研究推進センターにて準備します。
原資料とは元となる文書、データ及び記録のことを指します。(当院では主にカルテ、温度板、検査結果、放射線画像、病理結果、服薬指示書、服薬手帳など)
■臨床研究推進センターで準備できない原資料(医局保管の病歴など)については、担当医師にてご準備いただくことがあります。
CRCからのお願い
■カルテ、CRF等は明確なご記載をお願いします。不明瞭な箇所がありますと、全て担当医師へ問い合わせをさせて頂きます。
