研究者の方へ
医師主導研究(臨床研究法)
臨床研究法とは
臨床研究法(平成29年法律第16号)は、臨床研究の対象者をはじめとする国民の臨床研究に対する信頼の確保を図ることを通じてその実施を推進し、もって保健衛生の向上に寄与することを目的として、臨床研究の実施の手続、認定臨床研究審査委員会による審査意見業務の適切な実施のための措置、臨床研究に関する資金等の提供に関する情報の公表の制度等を定め、平成29年4月14日に公布され、臨床研究法施行規則(平成30年厚生労働省令第17号)とともに平成30年4月1日に施行されました。
臨床研究法に関する厚生労働省のホームページはこちらからご覧ください。
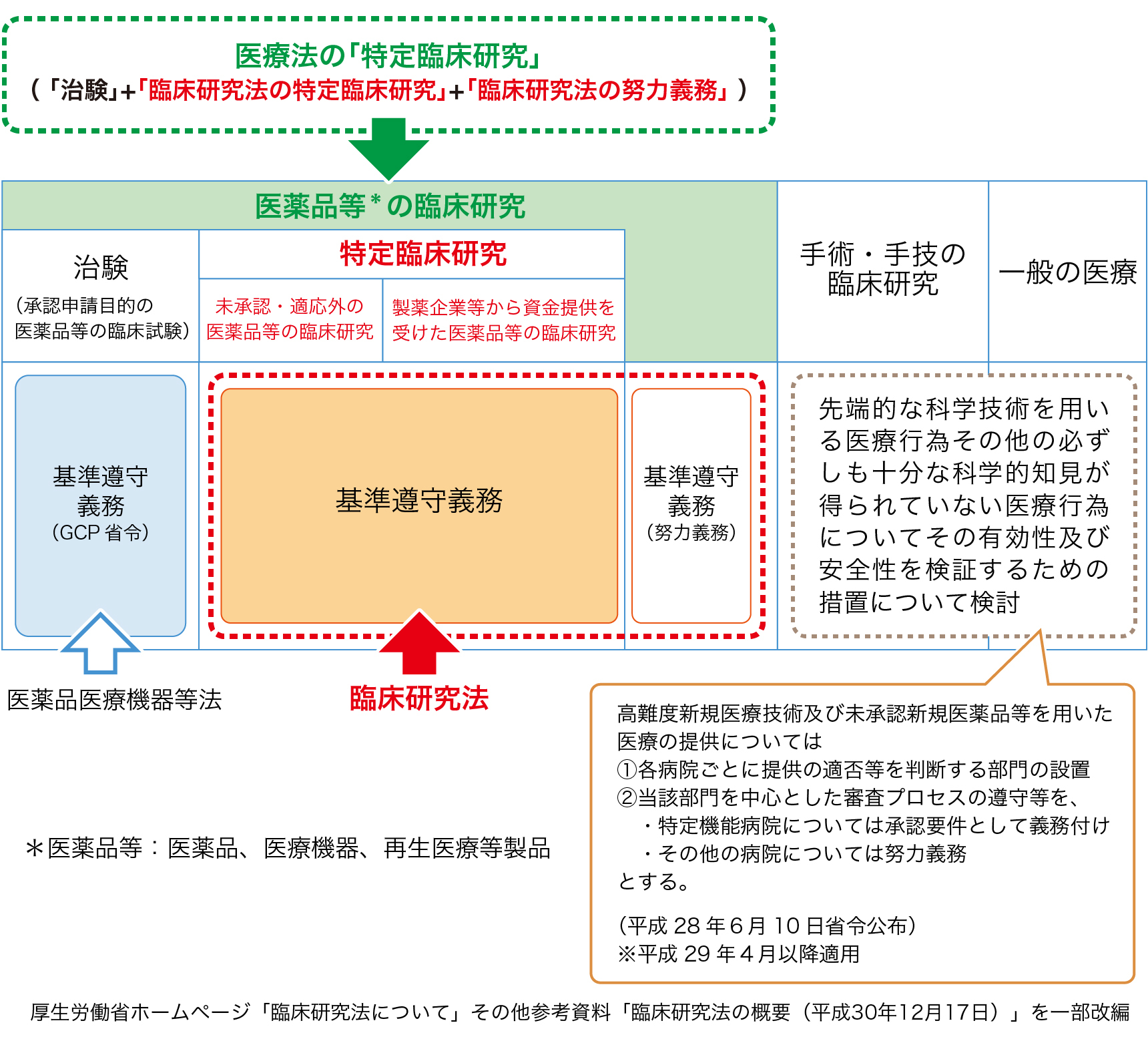
臨床研究法の臨床研究の範囲
この臨床研究法では「臨床研究」を、以下のように定義しております。
医薬品等*を人に対して用いることにより、当該医薬品等の有効性又は安全性を明らかにする研究
*医薬品等:医薬品、医療機器、再生医療等製品
「医薬品等を人に対して用いることにより、当該医薬品等の有効性又は安全性を明らかにする研究」とは、当該医薬品等の有効性(性能)又は安全性を明らかにする目的で、 医薬品等を人に対して投与又は使用すること(医行為に該当するもの)により行う研究をいう。
(医政経発 0228 第1号/医政研発 0228 第1号 平成30年2月28日)
さらに、この「臨床研究」のうち、以下のいずれかに該当する研究を”特定臨床研究”と定義しております。
- ●医薬品医療機器等法(薬機法)における未承認・適応外の医薬品等の臨床研究
- ●製薬企業等から資金提供を受けて実施される当該製薬企業等の医薬品等の臨床研究
そして、この「臨床研究」のうち、特定臨床研究に該当しない研究(非特定臨床研究)は臨床研究法で定める臨床研究実施基準の遵守に努める研究(いわゆる「努力義務の研究」)となります。
なお、臨床研究法の「特定臨床研究」は、医療法が定める臨床研究中核病院の承認要件である「特定臨床研究」※とは、解釈が異なりますのでご注意ください。
※医療法の特定臨床研究:臨床研究法の「特定臨床研究」の他、臨床研究法の「努力義務研究」と薬機法の「治験」も含みます。
以下の臨床研究は、臨床研究法の「臨床研究」には該当しません。
- ■企業治験、医師主導治験
- ■医薬品、医療機器、再生医療等製品の製造販売後調査等であって、再審査、再評価、使用成績評価に係るもの
- ■医療機器の認証に係る基準適合性に関する情報の収集のために行う試験(JIS規格に規定するものに限る。)
- ■いわゆる「観察研究」※
※研究の目的で検査、投薬その他の診断又は治療のための医療行為の有無及び程度を制御することなく、患者のために最も適切な医療を提供した結果としての診療情報又は試料の収集により得られた情報を利用する研究
臨床研究法の該当性について
臨床研究法の該当性は、該当性のチェックリストで確認できます。
また、より詳細な内容については、厚生労働省が示す事例(臨床研究法の施行等に関するQ&A(統合版)について(令和元年4月11日厚生労働省医政局研究振興課事務連絡)を参照してください。
また医療機器の場合は、日本生体医工学会が示す臨床研究法の該当性判断ガイドラインを参照してください。
これらの事例でも判断が難しい場合は、臨床研究推進センターのワンストップ相談窓口または東京大学臨床研究審査委員会の事務局(研究倫理支援室)にご相談ください。
また医療機器の場合は、以下の窓口でも相談を受付けていますのでご利用ください。
・医療機器の臨床研究に関する相談窓口
・SaMD一元的相談窓口(医療機器プログラム総合相談)
申請方法
当院が主任施設の場合(単施設研究の場合を含む)
当院が主任施設として実施する多施設共同研究や当院のみで実施する単施設研究は、研究開始前から研究終了までの期間は、原則として、東京大学臨床研究審査委員会(東大CRB)の審査を受けて研究を実施します。
多施設共同研究の場合は、東大CRBで一括審査を行いますので、当院以外の他施設が個別に当該施設の倫理委員会等で審査する必要はありません。(但し、他施設の規則等で個別審査を規定している場合を除く)
東大CRBでの審査を前提に、臨床研究を進めるフローは以下の通りです。
- 研究開始前:準備・申請手続き
- 研究実施中:変更・報告の手続き
-
- ↓↓クリックすると詳細が表示されます↓↓
- 第1症例目登録後の実施計画の情報更新
- 研究計画の変更
- 研究責任医師・臨床研究に従事する者の変更
- 研究計画からの逸脱・不適合報告
- 疾病等・不具合報告
- モニタリング・監査
- 定期報告
- 主要評価項目報告書の提出
- 研究中止
当院が分担施設の場合
他施設の研究者(研究代表医師)が計画した多施設共同研究に当院が分担施設として参加する場合は、研究開始前から研究終了までの期間は、研究代表医師が選定した認定臨床研究審査委員会(CRB)の審査を受けて研究を実施します。
そのため、本学医学部の倫理審査委員会等で個別に審査する必要はありません。
当院が分担施設として参加する多施設共同研究の場合の臨床研究を進めるフローは以下の通りです。
- 研究開始前:準備・申請手続き
-
- ↓↓クリックすると詳細が表示されます↓↓
- ワンストップ相談
- 研究倫理審査申請システムの登録
- 臨床研究に従事する者の選定
- 利益相反状況の確認
- ガイダンス・コンサルテーション
- 病院長への研究実施許可申請
- 契約の締結(必要時)
- jRCT公表情報の報告
- 研究開始
- 研究実施中:変更・報告の手続き
-
- ↓↓クリックすると詳細が表示されます↓↓
- 研究計画の変更(当院の情報変更)
- 研究責任医師・臨床研究に従事する者の変更
- 研究計画変更に対する病院長の許可申請
- 研究計画からの逸脱・不適合報告
- 疾病等・不具合報告
- モニタリング・監査
- 定期報告
- CRBの意見(審査結果通知書)の報告
- 研究中止
